再審査期間の指定
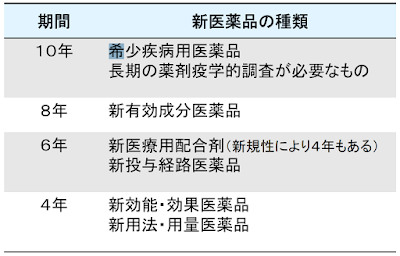
新医薬品等の再審査期間は、製造販売承認または承認事項一部変更承認の際に厚生労働大臣によって指示されます。(通常は8年)①希少疾病用医薬品(オーファンドラッグ)
長期の薬剤疫学的調査が必要なもの
10年
以下2つの項目のどちらにも合致するもの
- 対象者の数がわが国で年間5万人未満である医薬品
- その用途に関し、とくにすぐれた使用価値を有することとなる物
②新有効成分含有医薬品
8年③新医療用配合剤、新投与経路医薬品
6年④新効能・効果医薬品、新用法・新用量医薬品であってすでに承認された効能・効果が希少疾病医薬品として指定されたもののみ
5年10カ月⑤新効能・効果医薬品(④を除く)
新用法・新用量医薬品(④を除く)
4年
⑥先行する新医薬品の再審査期間中に承認された追っかけ新薬
先行新薬の再審査期間の残余期間
追っかけ新薬とは?
先行新薬の剤形追加、共同開発企業の追加申請および競合他社の同時開発などによるもの。
再審査期間の延長
厚生労働大臣は薬事・食品衛生審議会の意見を聴いて、調査期間を製造販売の承認のあった日以後10年を超えない範囲内において延長することができます。10年を超えない範囲内で延長できるケース
- 承認後の効能・効果の追加などにより希少疾病用医薬品または長期の薬剤疫学的調査が必要となったもの
- 小児の用法・用量設定のために治験または製造販売後臨床試験を行う必要があると認められた場合
ロナセンの再審査期間の延長通知(平成23年11月25日薬食発1125第4号)
http://www.city.funabashi.chiba.jp/jigyou/eisei/0009/h23yakumutsuuchi_d/fil/231125saishinsa.pdf