市販直後調査
GVPに規定されている定義
医薬品の製造販売業者が販売を開始した後の6ヵ月間診療において医薬品の適正使用を促し、重篤な副作用症例等の発生を迅速に把握するために行うものであって、リスク管理計画として行うものをいう
目的
- 医療機関に対し確実な情報提供、注意喚起を行い、新薬の適正使用に関する理解を促す
- 重篤な副作用および感染症(副作用等)の情報を迅速に収集し、必要な安全対策を実施することにより、副作用等の被害を最小限にする
市販直後調査実施計画書
市販直後調査の開始に先立ち作成するものです。
市販直後調査に関する以下を記載します。
- 調査の目的
- 予定する医療機関数
- 方法
- 実施期間
作成者
総括販売責任者または安全管理責任者
備え付ける場所
総括製造販売責任者がその業務を行う事務所
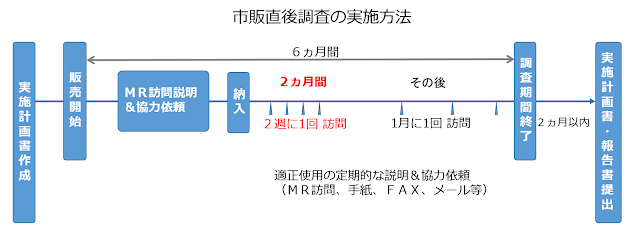
市販直後調査の手順
①納入前のMRによる説明および協力依頼- 製品情報概要や新医薬品使用上の注意の解説などにより、当該医薬品適正使用に関する情報について説明します
- 市販直後調査の依頼文書により、調査期間および副作用等が発現した場合の連絡について説明と協力依頼を行います
②納入前にMRによる説明および協力依頼が実施できない場合
- 納入前に文書で連絡後、納入開始後2週間以内を目安として、MRが訪問して、直接説明および協力依頼を行います
③納入後のMRによる説明および協力依頼
- 市販直後調査期間中は、当該医薬品納入後2ヵ月間は概ね2週間以内に1回、その後も概ね1ヵ月以内に1回の頻度で訪問し、製品情報概要や新医薬品使用上の注意の解説などにより繰り返し説明と協力依頼を行います
- 同時に、当該医薬品との関係が疑われる副作用等の有無を確認します
④副作用等の収集
- 当該医薬品との因果関係が否定できない副作用等の発生について情報を入手した場合には、その症例の経過確認と情報収集に努めます
⑤市販直後調査実施報告書
- 市販直後調査期間終了後2ヵ月以内に実施状況および重篤な副作用等の発生状況について、市販直後調査実施計画書とともに機構(PMDA)に提出します
MRによる説明および副作用等の確認は以下のように行われます
・使用患者の有無を確認する
・使用患者があれば、その患者についての有効性・安全性を確認する
・当該医薬品を使用しての問題点または副作用等を確認する
・問題点等がなければ、製品情報概要等により安全性等に関する説明を行う
・次回訪問日時のアポイントをとる
・MRは訪問記録を作成するとともに、手紙等のほかの手段を講じた場合であってもその記録を作成する
・使用患者があれば、その患者についての有効性・安全性を確認する
・当該医薬品を使用しての問題点または副作用等を確認する
・問題点等がなければ、製品情報概要等により安全性等に関する説明を行う
・次回訪問日時のアポイントをとる
・MRは訪問記録を作成するとともに、手紙等のほかの手段を講じた場合であってもその記録を作成する